分子晶体。
c60是什么晶体1
金刚石的化学式是什么
石墨和金刚石都属于碳单质,他们的化学性质完全相同。但金刚石和石墨不是同种物质,它们是由相同元素构成的同素异型体、
二者的化学式都是c
石墨原子间构成正六边形是平面结构,呈片状。
金刚石原子间是立体的正四面体结构,呈金字塔形结构、
C60是一种碳原子簇。它有确定的组成,60个碳原子构成像足球一样的32面体,包括20个六边形,12个五边形。C60是石墨、金刚石的'同素异形体
c60是由什么构成的
C60分子是一种由由60个碳原子构成像足球一样的32面体,包括20个六边形,12个五边形。这60个C原子在空间进行排列时,形成一个化学键最稳定的空间排列位置,恰好与足球表面格的排列一致。
C60分子它形似足球,因此又名足球烯。对于将C60及其一系列碳原子簇称为烯,根据有机化学系统命名原则,烯表示含双键的烃,而C60及其一系列碳原子簇是完全由碳原子组成的单质,并不是一种化合物,也不是烯烃。
C60的性质:
C60在室温下为紫红色固态分子晶体,有微弱荧光。C60分子的直径约为7、1埃(1埃=10-10米,即一百亿分之一米),C60的密度为1、68g/cm3。
分子轨道计算表明,足球烯具有较大的离域能。C60具有金属光泽,有许多优异性能,如超导、强磁性、耐高压、抗化学腐蚀、在光、电、磁等领域有潜在的应用前景。
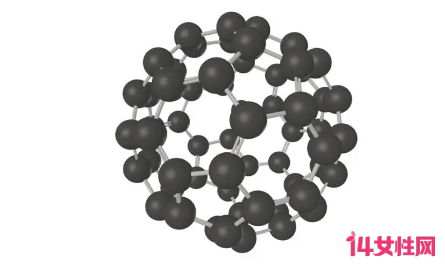
C60是什么晶体
只是一种碳分子的排列方式,不一定就是晶体啊。
就好象sio2也不一定都是水晶一样
C60是由60个C原子形成的笼状结构的分子,是富勒等最先制备出来,因此叫富勒烯,又叫足球烯、属于分子晶体,分子之间靠分子间作用力结合,熔点,硬度都不会很高,比金刚石差远了,
碳六十是什么晶体
解析:
富勒烯(学名),又称足球烯、碳六十、又译巴基球、巴克球(BuckyBall),英文为BuckminsterFuller,简称Fullerene。富勒烯也作为碳六十、碳七十等此类物质的统称。是与金刚石同素异形(同质多象)。
1985年9月4日18时56分4、7秒,在美国赖斯大学化学实验室,克鲁托(H、W、Kroto,英)、柯而(R、F、Curl,美)和史莫利(R、E、Smalley,美)三位教授从激光束照射石墨产物中用质谱法检出了由60个碳原子组成的球团碳六十分子,这一发现轰动科学界,它不仅为碳的同素异形体家族增添了一名新的成员,更重要的是,这个意料之外的发现开辟了化学研究的新领域,由此这三位科学家荣获1996年诺贝尔化学奖。
C60分子间通过范德华力形成分子晶体,熔、沸点较低,硬度较小,易溶于苯、酒精等有机溶剂,不导电。
c60是什么晶体2
c60即碳60,c60在室温下为紫红色固态分子晶体,有微弱荧光。c60具有金属光泽,具有超导、强磁性、耐高压、抗化学腐蚀等优异性能。c60的主要用途:增强金属、作催化剂、气体贮存、光学材料、高分子材料、医学应用等。
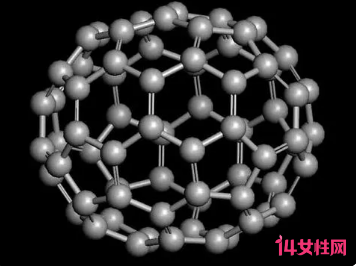
c60的'性质及用途
碳60是非金属单质,是单纯由60个碳原子结合形成的稳定分子,形似足球。它具有60个顶点和32个面,其中12个为正五边形,20个为正六边形。
c60具有特殊的化学活性,因而能进行加成反应而生成各种衍生物。其加成反应如:周环反应、加氢还原、羟基反应、开孔反应、氧化还原、加成反应、金属反应、颜色反应。
c60是什么晶体3
分子晶体,C60晶体是由大量C60分子通过分子间力结合而成的,分子间力容易被破坏,从而具有低熔点、低硬度等特点。
而金刚石晶体是由碳原子通过牢固的共价键结合而成的(晶体中所有的碳原子都通过共价键与相邻的`碳原子结合),这才是原子晶体,由于晶体中不存在较弱的分子间力,因此具有高熔点、高硬度的特点。
晶体类型
根据各类晶体的定义判断:
根据构成晶体的粒子和粒子间的作用力类别进行判断。如由阴、阳离子间通过离子键结合而形成的晶体属于离子晶体;由分子间通过分子间作用力(包括氢键)相结合形成的晶体属于分子晶体;由相邻原子间通过共价健相结合形成空间网状结构的晶体属于原子晶体。由金属阳离子和自由电子之间通过较强烈的相互作用(金属键)形成的晶体属于金属晶体。

根据物质所属类别判断:
1、活泼金属氧化物(Na2O、CaO、Na2O2等)、强碱和绝大多数盐类属于离子晶体(AlCl3、BeCl2例外,属于分子晶体);
2、大多数非金属单质(除金刚石、石墨、晶体硅、硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸和大多数有机物(除有机盐外)以及惰性气体均属于分子晶体;
3、金属单质(除汞外)和合金属于金属晶体;
4、金刚石、晶体硅、晶体二氧化硅、碳化硅、硼等属于原子晶体(一般只要记住前四个就可以了)。
根据各类晶体的特征性质判断
根据晶体的熔、沸点判断:
熔沸点低的单质和化合物一般为分子晶体;熔沸点较高的化合物一般为离子晶体;熔沸点很高的一般为原子晶体。






